您好,欢迎来到显微镜配件耗材官网!
 最新资讯返回
最新资讯返回UF-3D-SR: Ultra-Fast 3-Dimensional Super-Resolutionnanoscopy
相比于UH-3D-SR技术,UF-3D-SR技术能够实现更快速的三维超分辨成像,包括3D-SIM、宽场3D SOFI、多平面3D SOFI、转盘共聚焦3D SOFI等技术。2008年,Mats Gustafsson首次在实验上利用3D-SIM实现三维超分辨成像,使用光栅将入射光束分离出0级和±1级,三个衍射级次经物镜聚焦后汇聚于焦点处并发生相互干涉,形成三维空间条纹。3D-SIM的分辨率在横向可以达到100nm左右,纵向为280 nm左右,成像视场可达30×30 μm2,可以对整个细胞进行三维超分辨成像。
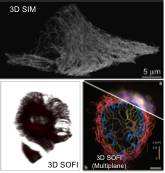
图 3 各种UF-3D-SR技术的超分辨图像
量子点的荧光间歇性提供了一种基于相关函数分析的超分辨成像方法SOFI (Super-resolution Optical FluctuationImaging)。3D SOFI可以通过多种不同的方法来实现,宽场3D SOFI是基于宽场显微镜的z轴扫描,实现三维SOFI超分辨成像。首先,以一定的步长采集各层的图像序列,然后对每一层的图像序列分别做SOFI分析,再将获得的各层二维SOFI超分辨图像做三维叠加重建和渲染,最终可以得到3D SOFI超分辨图像。Dertinger通过量子点标记细胞微管的实验,基于宽场成像的二阶3D SOFI可以得到215 nm左右的横向分辨率,成像视场为60×60×6 μm3。
三维SOFI超分辨成像除了在传统的宽场显微平台可以实现之外,还可通过多平面(Multiplane)同步成像的方式实现多平面3D SOFI成像。三组分束棱镜用于将光束分解成多路进行同步采集,两个图像探测器被分成8个独立的区域进行图像采集。每个区域采集的图像对应样品不同深度的图像信息,因此,系统可以同时对样品8个层进行图像序列采集,大大缩短了图像采集的时间。基于多平面的3D SOFI成像可以实现100-150 nm的横向分辨率和500 nm左右的轴向分辨率,相比于宽场成像,三个维度的空间分辨率都实现了明显的提升,成像的视场可达65×65×3.5 μm3。
三维SOFI超分辨成像还可以基于转盘共聚焦(Spinning-disk confocal)显微平台实现3D成像。通过转盘共聚焦采集闪烁图像序列,并通过移动z轴可以采集三维的图像信息。采集的各层图像序列首先通过SOFI处理,得到多层二维的超分辨图像;由于SOFI成像具有内在的三维超分辨成像特性,将各层SOFI处理得到的二维超分辨图像做三维重构,可以得到三维的超分辨图像。
UD-3D-SR: Ultra-Deep 3-Dimensional Super-Resolutionnanoscopy
UD-3D-SR技术能够实现大深度的三维超分辨成像。2014年,Chen等人提出三维晶格光切片显微成像技术(Lattice lightsheet),使用空间光调制器SLM生成晶格状的光场分布,利用振镜进行快速扫描,实现了深度高时空分辨率三维成像,成像深度可以突破50 μm。
传统的STED超分辨成像技术由于环形淬灭光在深度成像时会产生较大的像差,大大降低超分辨成像的质量,故难以实现大于100 μm深度的超分辨成像。最近,Yu等人提出GB-STED的方法,即使用高斯光束进行荧光激发,空心贝塞尔光束进行荧光淬灭实现深度STED超分辨成像。在GB-STED的成像过程中,借助于贝塞尔光束的无衍射特性,淬灭光的环形光强分布可以在样品深部区域得以很好地维持,所以样品深部区域仍然具有良好的荧光淬灭效果。在2 μm的成像深度,传统的STED和GB-STED均能够得到100 nm左右分辨率的图像;但是,当对155 μm深度的区域进行成像时,传统的STED环形光束在深度传输时受到像差和衍射的影响较大,导致成像的分辨率大大下降,而GB-STED在155 μm的深度仍然能够获得100 nm左右的分辨率,成像视场为5×5 μm2。因此,GB-STED有望实现大深度的三维超分辨成像。

图4 各种三维超分辨技术的轴向分辨率与成像深度的对比图。
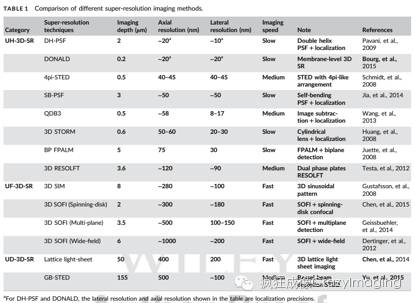
在过去十几年,各种三维超分辨成像技术的涌现极大地推动了在纳米尺度上进行生命科学领域的研究。从上图和表格可以看出,各种三维超分辨技术各有优势和不足,UH-3D-SR一般能够实现横向小于50 nm、轴向小于100 nm的空间分辨率,但是成像的视场相对较小,小于30×30×1 μm3。在组织水平的成像(成像深度大于20 μm),GB-STED在实验上实现了155 μm深度的超分辨成像。晶格光切片成像技术实现了大于50 μm的快速超分辨成像,可见,UD-3D-SR能够对细胞组织深部进行超分辨成像,但会在一定程度上牺牲成像的空间分辨率以及成像速度。而UF-3D-SR大大提高了成像的速度,但成像的速度和空间分辨率在一定程度上受到了限制。因此,超分辨成像的空间分辨率、成像深度和成像速度通常情况下是相互制约的,空间分辨率的提升常常是以牺牲时间分辨率为代价,或者时间分辨率的提升又牺牲了成像的视场。此外,对于STED成像,由于使用了很高的光功率密度,所以在对活细胞的成像时必须注意光毒性对细胞活性的影响。
总之,由于生命是以三维的形式存在并进行演化,所以,在发展超分辨技术时不仅要关注横向空间分辨率,更应该特别关注成像的深度、速度以及轴向分辨率。而且,在对活细胞成像时还应注意光毒性的影响。由于超分辨成像的各个参数之间通常是相互制约的,要实现同时大幅度提高各项参数在目前的技术水平还是存在较大的挑战性。目前更为可行的方案是根据所研究的具体问题对于成像参数的要求去发展相应的成像技术。随着超分辨技术的不断完善和各种新兴的超分辨技术的涌现,相信光学超分辨显微成像技术能够为各个领域的发展提供更强有力的技术支持和更好的解决方案。
参考文献:
[1] Pavani SRP, Thompson MA, Biteen JS,Lord SJ, Liu N, Twieg RJ, Piestun R, Moerner WE. 2009. Three-dimensional,single-molecule fluorescence imaging beyond the diffraction limit by using adouble-helix point spread function. Proc Natl Acad Sci 106:2995-2999.
[2] Bourg N, Mayet C, Dupuis G, Barroca T,Bon P, Lécart S, Fort E, Lévêque Fort S. 2015. Direct optical nanoscopy withaxially localized detection. Nat Photonics 9:587-593.
[3] Schmidt R, Wurm CA, Jakobs S,Engelhardt J, Egner A, Hell SW. 2008. Spherical nanosized focal spot unravelsthe interior of cells. Nat Methods 5:539-544.
[4] Jia S, Vaughan JC, Zhuang X. 2014.Isotropic three-dimensional super-resolution imaging with a self-bending pointspread function. Nat Photonics 8:302-306.
[5] Wang Y, Fruhwirth G, Cai E, Ng T,Selvin PR. 2013. 3D super-resolution imaging with blinking quantum dots. NanoLett 13:5233-5241.
[6] Huang B, Wang W, Bates M, Zhuang X.2008. Three-dimensional super-resolution imaging by stochastic opticalreconstruction microscopy. Science 319:810-813.
[7] Juette MF, Gould TJ, Lessard MD,Mlodzianoski MJ, Nagpure BS, Bennett BT, Hess ST, Bewersdorf J. 2008.Three-dimensional sub-100 nm resolution fluorescence microscopy of thicksamples. Nat Methods 5:527-529.
[8] Testa I, Urban NT, Jakobs S, EggelingC, Willig KI, Hell SW. 2012. Nanoscopy of living brain slices with low lightlevels. Neuron 75:992-1000.
[9] Gustafsson MG, Shao L, Carlton PM, WangC, Golubovskaya IN, Cande WZ, Agard DA, Sedat JW. 2008. Three-dimensional resolutiondoubling in wide-field fluorescence microscopy by structured illumination.Biophys J 94:4957-4970.
[10] Chen X, Zeng Z, Wang H, Xi P. 2015.Three-dimensional multimodal sub-diffraction imaging with spinning-diskconfocal microscopy using blinking/fluctuating probes. Nano Res 8:2251-2260.
[11] Geissbuehler S, Sharipov A, Godinat A,Bocchio NL, Sandoz PA, Huss A, Jensen NA, Jakobs S, Enderlein J, Van Der GootFG. 2014. Live-cell multiplane three-dimensional super-resolution opticalfluctuation imaging. Nat Commun 5:5830.
[12] Dertinger T, Xu J, Naini OF, Vogel R,Weiss S. 2012. SOFI-based 3D superresolution sectioning with a widefieldmicroscope. Opt Nanosc 1:1-5.
[13] Yu W, Ji Z, Dong D, Yang X, Xiao Y,Gong Q, Xi P, Shi K. 2016. Super-resolution deep imaging with hollow Besselbeam STED microscopy. Laser & Photonics Reviews 10:147-152.